
首頁(yè) > 資訊中心> 行業(yè)資訊 > 深度解讀體外診斷GMP審查要點(diǎn)
2017-06-13
檢查依據(jù):
《藥品醫(yī)療器械飛行檢查辦法》(2015年總局令第14號(hào))
《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》(2014年第64號(hào))
《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范附錄體外診斷試劑》(2015年第103號(hào))
《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范體外診斷試劑現(xiàn)場(chǎng)檢查指導(dǎo)原則》食藥監(jiān)械監(jiān)〔2015〕218號(hào)
相關(guān)標(biāo)準(zhǔn)
YY0287-2017《醫(yī)療器械 質(zhì)量管理體系 用于法規(guī)的要求》
相關(guān)法規(guī):
《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國(guó)務(wù)院令 650 號(hào))
《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》(局令 7 號(hào))
檢查范圍:
醫(yī)療器械生產(chǎn)企業(yè)在醫(yī)療器械設(shè)計(jì)開發(fā)、生產(chǎn)、銷售和售后服務(wù)等過(guò)程中應(yīng)當(dāng)遵守以上法規(guī)的要求。
責(zé)任主體:
企業(yè)應(yīng)當(dāng)依照以上規(guī)范的要求,結(jié)合產(chǎn)品特點(diǎn),建立健全與所生產(chǎn)醫(yī)療器械相適應(yīng)的質(zhì)量管理體系,并保證其有效運(yùn)行。
風(fēng)險(xiǎn)意識(shí):
企業(yè)應(yīng)當(dāng)將風(fēng)險(xiǎn)管理貫穿與設(shè)計(jì)開發(fā),生產(chǎn),銷售和售后服務(wù)等全過(guò)程,所采取的措施應(yīng)當(dāng)與產(chǎn)品存在的風(fēng)險(xiǎn)相適應(yīng)。
簡(jiǎn)點(diǎn)說(shuō)明:
如何檢查,查什么?怎么查?基于風(fēng)險(xiǎn),根據(jù)產(chǎn)品特性、生產(chǎn)工藝、生產(chǎn)規(guī)模,圍繞產(chǎn)品生產(chǎn)需要實(shí)施檢查。
醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范 GMP 是體外試劑生產(chǎn)管理和質(zhì)量控制的基本要求,旨在最大限度地降低試劑生產(chǎn)過(guò)程中,污染、交叉污染以及混淆、差錯(cuò)等風(fēng)險(xiǎn),確保持續(xù)穩(wěn)定地生產(chǎn)出符合預(yù)期用途和注冊(cè)要求的產(chǎn)品,其宗旨是為保障醫(yī)療器械安全、有效,規(guī)范醫(yī)療器械生產(chǎn)質(zhì)量管理
第一節(jié):機(jī)構(gòu)和人員
飛檢案例:
1、企業(yè)負(fù)責(zé)人未對(duì)企業(yè)質(zhì)量體系運(yùn)行情況進(jìn)行評(píng)估
2、企業(yè)未提供文件發(fā)放實(shí)施前培訓(xùn)記錄
3、進(jìn)入潔凈區(qū)的工作人員未進(jìn)行微生物知識(shí)培訓(xùn),也無(wú)相關(guān)培訓(xùn)計(jì)劃
4、潔凈間直接接觸物料和產(chǎn)品的人員未進(jìn)行健康體驗(yàn)
5、進(jìn)入潔凈區(qū)需戴一次性無(wú)菌手套,但未在人員進(jìn)出潔凈區(qū)管理規(guī)程中明確戴手套的相關(guān)要求等
關(guān)鍵點(diǎn):
人是生產(chǎn)質(zhì)量管理過(guò)程中最主要的,尤其是基本的操作人員
組織機(jī)構(gòu)控制;人員職責(zé)明確;培訓(xùn)是必要的基本保障:三項(xiàng)是檢查必查項(xiàng)目
1、企業(yè)負(fù)責(zé)人:
(1)組織制定質(zhì)量方針和質(zhì)量目標(biāo)
(2)組織實(shí)施管理評(píng)審,定期對(duì)質(zhì)量管理體系運(yùn)行情況進(jìn)行評(píng)估,并持續(xù)改進(jìn)。
(3)確保企業(yè)按照法律、法規(guī)和規(guī)章的要求組織生產(chǎn)
(4)確保質(zhì)量管理體系有效運(yùn)行所需的人力資源、基礎(chǔ)設(shè)施和工作環(huán)境。
(5)應(yīng)當(dāng)確定一名管理者代表
3、管理者代表:
(1)應(yīng)當(dāng)負(fù)責(zé)建立(質(zhì)量管理體系所需的過(guò)程形成文件)、實(shí)施并保持質(zhì)量管理體系
(2)報(bào)告質(zhì)量管理體系的運(yùn)行情況(向最高管理者和監(jiān)督單位)和改進(jìn)需求
(3)提高員工滿足法規(guī)、規(guī)章和顧客要求的意識(shí)
4、其他負(fù)責(zé)人:
(1)技術(shù)、生產(chǎn)、質(zhì)量管理部門負(fù)責(zé)人應(yīng)當(dāng)熟悉醫(yī)療器械法律法規(guī)
(2)具有質(zhì)量管理的實(shí)踐經(jīng)驗(yàn)(學(xué)歷背景、工作經(jīng)歷)
(3)應(yīng)當(dāng)有能力對(duì)生產(chǎn)管理和質(zhì)量管理中實(shí)際問(wèn)題作出正確判斷和處理
(4)體外診斷試劑生產(chǎn)、技術(shù)和質(zhì)量管理人員應(yīng)當(dāng)具有醫(yī)學(xué)、檢驗(yàn)學(xué)、生物學(xué)、免疫學(xué)或藥學(xué)等
2、職責(zé)權(quán)限
(1)生產(chǎn)管理部門和質(zhì)量管理部門負(fù)責(zé)人不得相互兼任
(2)確保生產(chǎn)和質(zhì)量管理完整性、合理性
(3)部門職責(zé)和權(quán)限清晰,職能明確完整,不交叉,不重疊,補(bǔ)缺位,不空位
(4)任命書或授權(quán)文件應(yīng)與實(shí)際權(quán)限一致
注意在組織機(jī)構(gòu)圖基礎(chǔ)上,需要進(jìn)一步明確產(chǎn)品實(shí)現(xiàn)過(guò)程中各環(huán)節(jié)的管理程序,出現(xiàn)各種問(wèn)題時(shí),如何進(jìn)行協(xié)調(diào)管理,并最終實(shí)現(xiàn)有效控制
5、人員檔案
(1)從事影響產(chǎn)品質(zhì)量工作的人員,應(yīng)當(dāng)定期進(jìn)行培訓(xùn)(如衛(wèi)生、微生物學(xué)、潔凈作業(yè)、安全防護(hù)等)
(2)建立人員健康檔案,每年至少體檢一次,患有傳染性和感染性疾病的人員不得從事直接接觸產(chǎn)品的工作
6、潔凈要求
(1)進(jìn)入潔凈室(區(qū))應(yīng)當(dāng)按照程序進(jìn)行凈化,并穿戴工作帽、口罩、潔凈工作服、工作鞋
(2)手接觸產(chǎn)品的操作人員每隔一定時(shí)間應(yīng)當(dāng)對(duì)手再次進(jìn)行消毒
(3)裸手消毒劑的種類應(yīng)當(dāng)定期更換。
(4)潔凈工作服和無(wú)菌工作服選擇質(zhì)地光滑、不易產(chǎn)生靜電、不脫落纖維和顆粒性物質(zhì)的材料制作
第二節(jié):廠房與設(shè)施
飛檢案例:
1、十萬(wàn)級(jí)潔凈生產(chǎn)車間天花板有漏水和修補(bǔ)痕跡,有銹跡
2、產(chǎn)品工藝用水制水設(shè)備設(shè)置在潔凈車間內(nèi),制水間地面有積水
3、企業(yè)的危險(xiǎn)化學(xué)品庫(kù)位于理化檢測(cè)室內(nèi),無(wú)通風(fēng)和消防等措施,《化學(xué)危險(xiǎn)品管理規(guī)程》規(guī)定的管理職責(zé)不明確
4、換鞋間、緩沖間走廊、女一更、女二更照明燈損壞不亮
5、外包間傳遞窗和工藝用水制水間的入口均位于員工進(jìn)餐休息室內(nèi)
6、產(chǎn)品儲(chǔ)存要求與實(shí)際記錄等不一致
7、溫濕度分布均勻性以及可能對(duì)生產(chǎn)過(guò)程的影響未進(jìn)行驗(yàn)證評(píng)估
8、凈化車間門口防鼠板與門框和墻壁間存在較大空隙,且不固定
9、未能按照《沉降菌監(jiān)測(cè)制度》提供沉降菌的監(jiān)測(cè)記錄
10、陰性、陽(yáng)性質(zhì)粒的分裝在十萬(wàn)級(jí)下的生物安全柜內(nèi)進(jìn)行,未能提供生物安全柜有關(guān)微生物的檢測(cè)或檢測(cè)結(jié)果,以證明其內(nèi)操作環(huán)境相當(dāng)于或高于10000級(jí)潔凈度級(jí)別
關(guān)鍵點(diǎn):
1、潔凈室(區(qū))空氣潔凈度級(jí)別
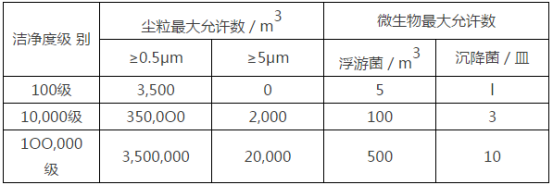
(1)酶聯(lián)免疫吸附試驗(yàn)試劑、免疫熒光試劑、免疫發(fā)光試劑、聚合酶鏈反應(yīng)(PCR)試劑、金標(biāo)試劑、干化學(xué)法試劑、細(xì)胞培養(yǎng)基、校準(zhǔn)品與質(zhì)控品、酶類、抗原、抗體和其他活性類組分的配制及分裝等產(chǎn)品的配液、包被、分裝、點(diǎn)膜、干燥、切割、貼膜以及內(nèi)包裝等,生產(chǎn)區(qū)域應(yīng)當(dāng)不低于100,000級(jí)潔凈度級(jí)別
(2)陰性或陽(yáng)性血清、質(zhì)粒或血液制品等的處理操作,生產(chǎn)區(qū)域應(yīng)當(dāng)不低于10,000級(jí)潔凈度級(jí)別,并應(yīng)當(dāng)與相鄰區(qū)域保持相對(duì)負(fù)壓
(3)無(wú)菌物料等分裝處理操作,操作區(qū)域應(yīng)當(dāng)符合局部100級(jí)潔凈度級(jí)別
(4)100級(jí)的潔凈室(區(qū))內(nèi)不得設(shè)置地漏
2、倉(cāng)儲(chǔ)
IVD 所用原輔材料較多,且不易辨別,貯存條件要求高,保存時(shí)限短,倉(cāng)儲(chǔ)管理必須做到:
(1)與生產(chǎn)規(guī)模匹配,區(qū)域(待驗(yàn)、合格、不合格、退貨或召回)必須劃分清楚
(2)環(huán)境控制滿足產(chǎn)品的需求,如冷藏、冷凍、干燥等,定期的數(shù)據(jù)監(jiān)控記錄。
(3)所有物料應(yīng)明確標(biāo)識(shí)和分類。
(4)貯存物料不得直接接觸地面
(5)建立貨位卡和臺(tái)帳,內(nèi)容應(yīng)與實(shí)物相符,并能反應(yīng)出物料的基本信息。
注意,所有物料必須做好標(biāo)識(shí)和分類
3、廠房
(1)廠區(qū)應(yīng)當(dāng)遠(yuǎn)離有污染的空氣和水等污染源的區(qū)域:如大氣含塵濃度、含菌濃度較低,空氣中有害物質(zhì)較少,無(wú)嚴(yán)重污染源,遠(yuǎn)離鐵路,碼頭,交通咬掉以及散發(fā)大量粉塵,煙氣和有害氣體的工廠,堆場(chǎng)等有嚴(yán)重空氣污染,及噪聲干擾的地方。
(2)生產(chǎn)廠房、設(shè)施是實(shí)施規(guī)范的先決條件,廠房設(shè)計(jì)布局,建造及其配套設(shè)施應(yīng)與產(chǎn)品特性,生產(chǎn)規(guī)模相適應(yīng),便于清潔和日常維護(hù)
(3)不同區(qū)域不得相互妨礙,如不同產(chǎn)品同時(shí)或共線生產(chǎn)的影響,研發(fā)過(guò)程中未知因素對(duì)生產(chǎn)的影響,檢驗(yàn)過(guò)程中陽(yáng)性因子對(duì) 生產(chǎn)的影響等
(4)危險(xiǎn)品倉(cāng)庫(kù)應(yīng)設(shè)置在安全地方,防凍,降溫,消防措施
(5)廠房應(yīng)當(dāng)設(shè)置防塵、防止昆蟲和其他動(dòng)物進(jìn)入的設(shè)施。
n 生產(chǎn)區(qū)域的調(diào)整,變動(dòng),應(yīng)按照程序文件批準(zhǔn),必要時(shí)要進(jìn)行驗(yàn)證。
n 通常質(zhì)量檢驗(yàn)室單獨(dú)建造:質(zhì)量檢驗(yàn)室單獨(dú)建造的意思是不要與生產(chǎn)共用空調(diào)系統(tǒng)、潔凈室等功能/空間、儀器與試劑檢驗(yàn)要求和生產(chǎn)規(guī)模匹配。如:理化檢驗(yàn)、精密儀器、生物檢驗(yàn)、無(wú)菌檢驗(yàn)、微生物檢驗(yàn)、陽(yáng)性對(duì)照室、留樣室。PCR 產(chǎn)品檢驗(yàn)室等特殊檢驗(yàn)室要符合國(guó)家特別規(guī)定。
n 精密操作或易受環(huán)境條件影響的,如生物反應(yīng)過(guò)程,或者抗原抗體制備,細(xì)胞培養(yǎng),病原微生物培
養(yǎng)和處理,基因擴(kuò)增,陽(yáng)性物質(zhì)培養(yǎng)分離等特殊生物加工技術(shù)的都必須有單獨(dú)的生產(chǎn)空間。
4、潔凈室
(1)進(jìn)入潔凈室(區(qū))的管道、進(jìn)回風(fēng)口布局應(yīng)當(dāng)合理,水、電、氣輸送線路與墻體接口處應(yīng)當(dāng)可靠密封,照明燈具不得懸吊
(2)潔凈室(區(qū))的門、窗及安全門應(yīng)當(dāng)密閉,潔凈室(區(qū))的門應(yīng)當(dāng)向潔凈度高的方向開啟
(3)在同一潔凈度區(qū)域內(nèi),人流和物流只能盡量做到單向流動(dòng),是無(wú)法明確區(qū)分的,因此所謂的人物流區(qū)分是指在人員和物料進(jìn)入、傳出的情況下盡量分隔潔凈區(qū)
(4)有毒有害傳染性或污染性,具有活生物體的物料應(yīng)設(shè)專區(qū)(柜)保存
(5)空氣潔凈級(jí)別不同的潔凈室(區(qū))之間的靜壓差應(yīng)當(dāng)大于5帕,潔凈室(區(qū))與室外大氣的靜壓差應(yīng)大于10帕,并應(yīng)當(dāng)有指示壓差的裝置
(6)相同級(jí)別潔凈室間的壓差梯度應(yīng)當(dāng)合理
(7)潔凈室(區(qū))的空氣如循環(huán)使用應(yīng)當(dāng)采取有效措施避免污染和交叉污染
(8)潔凈室(區(qū))內(nèi)的水池、地漏應(yīng)安裝防止倒灌的裝置
(9)產(chǎn)塵操作間應(yīng)防止粉塵擴(kuò)散,避免交叉污染
(10)污染性、傳染性和高生物活性的物料應(yīng)當(dāng)在受控條件下進(jìn)行處理,避免造成傳染、污染或泄漏等。
(11)生產(chǎn)激素類、操作有致病性病原體、芽胞菌制品的區(qū)域與其他類產(chǎn)品生產(chǎn)區(qū)域嚴(yán)格分開。如系多樓層建筑,在同一生產(chǎn)層面與其他一般品種的生產(chǎn)線不能共用物料通道、人員通道、包裝線等,防止產(chǎn)品交叉污染。
(12)獨(dú)立的空氣凈化系統(tǒng),排出的空氣不能循環(huán)使用。
(13)危險(xiǎn)度二級(jí)及以上的病原體操作應(yīng)當(dāng)配備生物安全柜,空氣應(yīng)當(dāng)進(jìn)行過(guò)濾處理后方可排出。
(14)應(yīng)當(dāng)對(duì)過(guò)濾器的性能進(jìn)行定期檢查
(15)生產(chǎn)聚合酶鏈反應(yīng)(PCR)試劑的,其生產(chǎn)和檢驗(yàn)應(yīng)當(dāng)在獨(dú)立的建筑物或空間內(nèi),保證空氣不直接聯(lián)通,防止擴(kuò)增時(shí)形成的氣溶膠造成交叉污染。生產(chǎn)聚合酶鏈反應(yīng)(PCR)試劑的,其生產(chǎn)和質(zhì)檢的器具不得混用,用后應(yīng)嚴(yán)格清洗和消毒
第三節(jié):設(shè)備
飛檢案例:
1、企業(yè)未對(duì)空調(diào)凈化機(jī)組中效過(guò)濾器進(jìn)行壓差監(jiān)控
2、企業(yè)自校準(zhǔn)溫濕度計(jì)所采用的方法為非標(biāo)方法,未經(jīng)驗(yàn)證
3、企業(yè)提供的2~10μl移液器檢定報(bào)告顯示計(jì)量用具為萬(wàn)分之一天平;2μl移液器實(shí)測(cè)值為1.8μl,超過(guò)其誤差2%范圍規(guī)定,未對(duì)檢定報(bào)告有效性進(jìn)行確認(rèn)
4、企業(yè)采用紫外燈對(duì)潔凈車間進(jìn)行消毒.未對(duì)消毐效果進(jìn)行有效驗(yàn)證
5、企業(yè)生產(chǎn)體外診斷試劑產(chǎn)品具有不連續(xù)性,空氣凈化系統(tǒng)停機(jī)時(shí)間較長(zhǎng),企業(yè)尚未對(duì)不同停機(jī)時(shí)間后再次開啟空氣凈化系統(tǒng)所需采取的措施進(jìn)行相應(yīng)的驗(yàn)證和規(guī)定
6、空調(diào)凈化系統(tǒng)清潔維修保養(yǎng)規(guī)定初效每個(gè)月清洗一次,中效三個(gè)月清洗一次,高效過(guò)濾器每年監(jiān)測(cè)完整性,但企業(yè)實(shí)際對(duì)初、中效每年更換,實(shí)際也未監(jiān)測(cè)高效過(guò)濾器的完整性
7、企業(yè)生產(chǎn)體外診斷試劑具有不連續(xù)性,空氣凈化系統(tǒng)停機(jī)時(shí)間較長(zhǎng),企業(yè)尚未對(duì)不同停機(jī)時(shí)間后再次開啟空氣凈化系統(tǒng)所需采取的措施進(jìn)行相應(yīng)的驗(yàn)證和規(guī)定
8、空氣凈化系統(tǒng)未進(jìn)行確認(rèn)和驗(yàn)證,未進(jìn)行初中效壓差監(jiān)控;空調(diào)凈化系統(tǒng)不連續(xù)運(yùn)行,未對(duì)再次開啟運(yùn)行條件進(jìn)行確認(rèn)
9、純化水微生物檢測(cè)標(biāo)準(zhǔn)規(guī)定的檢測(cè)量為0.1ml,藥典標(biāo)準(zhǔn)規(guī)定檢測(cè)量為1ml。
10、未對(duì)潔凈車間工藝用水儲(chǔ)水桶進(jìn)行清洗消毒記錄
11、未對(duì)純化水的全性能檢測(cè)周期進(jìn)行規(guī)定
關(guān)鍵點(diǎn):
設(shè)備是體外診斷試劑生產(chǎn),必備的硬件要求,也是滿足生產(chǎn)質(zhì)量的基本條件。設(shè)備的特性和選型必須與產(chǎn)
品特性,生產(chǎn)規(guī)模相適應(yīng)。便于清潔和日常維護(hù)。
原則:設(shè)備的設(shè)計(jì)、選型、安裝、維修和維護(hù)必須符合預(yù)定的用途,應(yīng)盡可能降低產(chǎn)生污染,交叉污染,
混淆和差錯(cuò)的風(fēng)險(xiǎn),便于操作,清潔,維護(hù),以及必要時(shí)消毒或滅菌。
(1)與生產(chǎn)品種、生產(chǎn)規(guī)模匹配,符合預(yù)期用途(工藝要求,工藝參數(shù)&質(zhì)量控制,生產(chǎn)效率等)
(2)與檢驗(yàn)項(xiàng)目要求相適應(yīng),如原材料,中間產(chǎn)品,成品包括精度和數(shù)量
(3)計(jì)量器具及其量程和精度
(4)直接接觸物料或產(chǎn)品的設(shè)備、容器具及管道表面及其材質(zhì)(無(wú)毒、耐腐蝕、不與物料或產(chǎn)品發(fā)生化學(xué)反應(yīng)/粘連、易于清潔,消毒/滅菌)
(5)維護(hù)、維修(重大維修應(yīng)再確認(rèn))
(6)狀態(tài)標(biāo)示(名稱、規(guī)格、批號(hào)),防止非預(yù)期使用;標(biāo)明清潔狀態(tài)等,包括主要固定管道表明內(nèi)容物名和流向
第四節(jié):文件管理
飛檢案例:
1、外來(lái)文件的收集和整理不及時(shí),未收集新發(fā)布的法規(guī)文件和標(biāo)準(zhǔn),并作為外來(lái)受控文件進(jìn)行管理
2、無(wú)文件分發(fā)、回收、銷毀記錄,或分發(fā)記錄與實(shí)際使用文件版本不一致,或未進(jìn)行版本控制
3、記錄嚴(yán)重失實(shí),檢查生產(chǎn)記錄發(fā)現(xiàn),某休假人員在休假期間有簽字和日期
4、記錄存在涂改,且未標(biāo)注更改者姓名和更改日期。
5、查看企業(yè)提供的實(shí)驗(yàn)室檢測(cè)培訓(xùn)資料,發(fā)現(xiàn)紙張背面為質(zhì)檢室清潔衛(wèi)生記錄。
6、原料入庫(kù)臺(tái)賬使用WPS文件,可任意修改,不符合《記錄控制程序》要求;未按《風(fēng)險(xiǎn)管理控制程序》的要求對(duì)風(fēng)險(xiǎn)管理文件進(jìn)行存檔。
關(guān)鍵點(diǎn)
文件是質(zhì)量保證體系的基本要素。為保證質(zhì)量體系的有效運(yùn)行,良好的文件系統(tǒng)及其記錄是不可或缺的。
文件能夠有效的避免信息口頭交流可能引起的差錯(cuò),記錄是確證產(chǎn)品生產(chǎn)和質(zhì)量控制的全過(guò)程的可追溯。
1、文件
(1)質(zhì)量管理體系文件:包括質(zhì)量方針和質(zhì)量目標(biāo)、手冊(cè)、程序文件、技術(shù)文件、法規(guī)要求等(程序文件至少有 26 個(gè))
(2)文件的起草、修訂、審核、批準(zhǔn)、替換或者撤銷、復(fù)制、保管和銷毀等應(yīng)當(dāng)按照控制程序管理,并有
(3)相應(yīng)的文件分發(fā),替換或者撤銷,復(fù)制和銷毀記錄。
(4)文件更新或者修訂時(shí),應(yīng)當(dāng)按規(guī)定評(píng)審和批準(zhǔn),能夠識(shí)別文件的更改和修訂狀態(tài),防止舊版文件誤用。
(5)分發(fā)和使用的文件應(yīng)當(dāng)為適宜的文本(批準(zhǔn)的現(xiàn)行文本),已撤銷或者作廢的文件應(yīng)當(dāng)進(jìn)行標(biāo)識(shí),防止誤用(除留檔備查外,不得在工作現(xiàn)場(chǎng)出現(xiàn))
2、記錄
(1)記錄控制程序,包括記錄的標(biāo)識(shí),保管,檢索,保存期限和處置等 4 個(gè)方面
(2)每批產(chǎn)品應(yīng)當(dāng)有記錄,包括批生產(chǎn)記錄,批包裝記錄,批檢驗(yàn)記錄和產(chǎn)品放行審核記錄等。批記錄
(3)應(yīng)當(dāng)由質(zhì)量管理部門負(fù)責(zé)管理,至少保存至產(chǎn)品有效期后一年。
(4)質(zhì)量標(biāo)準(zhǔn),工藝規(guī)程,操作規(guī)程,穩(wěn)定性考察,確認(rèn)和驗(yàn)證,變更等企業(yè)重要文件應(yīng)長(zhǎng)期保存。
(5)SOP 要保證操作者在依照實(shí)施時(shí)盡量少動(dòng)腦,記錄要盡量減少寫字內(nèi)容,盡量打鉤
(6)如果使用電子數(shù)據(jù)處理系統(tǒng),照相技術(shù)或其他可靠方式記錄數(shù)據(jù)資料,應(yīng)當(dāng)有所有的系統(tǒng)的操作程序;
(7)記錄的準(zhǔn)確性應(yīng)當(dāng)核對(duì)。且只有經(jīng)授權(quán)人員輸入或更改數(shù)據(jù),更好和刪除應(yīng)當(dāng)有記錄(痕跡);應(yīng)當(dāng)使用密碼或其他方式控制系統(tǒng)的登錄,關(guān)鍵數(shù)據(jù)輸入后,應(yīng)當(dāng)由他人獨(dú)立進(jìn)行復(fù)核。
(8)用電子方式保存記錄,應(yīng)當(dāng)采用磁帶,微縮膠卷、紙質(zhì)副本或其他方法進(jìn)行備份。以確保記錄的安全,數(shù)據(jù)資料在保存期內(nèi)便于查閱。
LATEST NES
2016年9月23日,孚諾科技(大連)有限公司生產(chǎn)的800速全自動(dòng)生化分析儀FC-800取得醫(yī)療器械注冊(cè)證。 FC-800具有恒速800測(cè)試/小時(shí)(ISE使用時(shí)1200測(cè)試/小時(shí)),采用最新的超微量技術(shù),最小反應(yīng)液量
孚諾科技(大連)有限公司是日本古野電氣株式會(huì)社的全資子公司。古野集團(tuán)經(jīng)過(guò)幾十年的技術(shù)積累及激烈的市場(chǎng)競(jìng)爭(zhēng),成為日本高端檢驗(yàn)設(shè)備制造商。所生產(chǎn)的全自動(dòng)生化分析儀得
2016年3月7日-3月9日,第十三屆中國(guó)(國(guó)際)檢驗(yàn)醫(yī)學(xué)暨輸血儀器試劑博覽會(huì),在西安曲江國(guó)際會(huì)展中心如期舉行。 孚諾科技攜古野電氣集團(tuán)最新研發(fā)的FC800全自動(dòng)生化儀首次在國(guó)內(nèi)亮相。FC-80